La maladie bronchique féline correspond à un groupe de maladies inflammatoires des voies aériennes distales. De nombreux synonymes existent, ainsi on parle également de bronchite asthmatiforme, de bronchite chronique… Cette diversité de dénomination reflète les variabilités clinique, radiographique… de cette affection. Certains auteurs tendraient d’ailleurs à scinder ce syndrome en deux groupes, la bronchite chronique et l’asthme félin.
La physiopathogénie n’est pas complètement élucidée. Elle repose notamment sur une hyper réactivité des voies aériennes conduisant à une diminution, réversible, du diamètre des voies aériennes (Schéma 1). Plusieurs évènements sont impliqués, en particulier une hypersensibilité de type I secondaire à l’exposition à un aéro allergène. Lors d’une nouvelle exposition à cet allergène, les mastocytes sensibilisés libèrent des cytokines pro inflammatoires (histamine et sérotonine sont les plus connues) et des médiateurs stimulant le recrutement de granulocytes éosinophiles dans les poumons. L’activité locale des granulocytes éosinophiles et les autres cytokines produites induisent un déséquilibre du système adréno-cholinergique responsable de la contraction des muscles lisses respiratoires (bronchoconstriction).
Le profil inflammatoire présent au cours de l’asthme induit également une hyperplasie des cellules caliciformes et donc une augmentation de la production de mucus. Ceci participe à la réduction du calibre des voies aériennes.
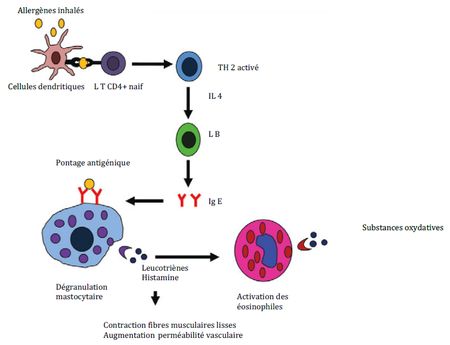 Schéma 1 : Physiopathologie de la réaction d’hypersensibilité de type I au cours de la bronchite asthmatiforme.
Schéma 1 : Physiopathologie de la réaction d’hypersensibilité de type I au cours de la bronchite asthmatiforme.
En résumé, l’asthme fait suite à une diminution du diamètre des voies aériennes, cumul d’une bronchoconstriction, d’une augmentation de la sécrétion de mucus et d’un épaississement de la paroi des bronches secondaire à l’infiltration par des cellules inflammatoires (Schéma 2). Cette diminution de diamètre des voies aériennes conduit à un défaut d’expiration. L’air présent dans les alvéoles ne peut être expulsé. On parle d’effet trappe. Sous la pression intra luminale, l’alvéole se dilate parfois jusqu’à se rompre.
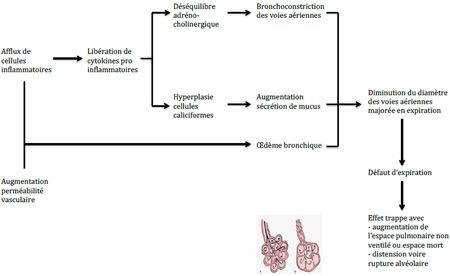 Schéma 2 : Conséquences physiopathologiques de l’asthme
Schéma 2 : Conséquences physiopathologiques de l’asthme
Les motifs de consultation les plus fréquents de l’asthme sont de la toux, une dyspnée avec des épisodes de respiration gueule ouverte, des sifflements et une intolérance à l’effort. Certains chats peuvent rester asymptomatiques entre des épisodes occasionnels d’obstruction aiguë des voies respiratoires.
Les résultats de l’examen clinique sont très variables, celui-ci peut être normal, discrètement modifié avec un unique allongement de la phase expiratoire ou très modifié avec une dyspnée marquée et des sifflements audibles.
L’auscultation pulmonaire peut mettre en évidence des sifflements ou des crépitements.
L’asthme ou bronchite chronique est souvent suspectée à l’issu du recueil de l’anamnèse et de l’examen clinique. Le recours à des examens complémentaires invasifs (LBA…) est pourtant nécessaire au diagnostic de certitude de cette maladie pour laquelle les modifications biochimiques et radiologiques ne sont pas spécifiques.
Examens complémentaires
Une éosinophilie sanguine est rapportée dans 30% de cas d’asthme. Cette anomalie s’observe cependant aussi lors de parasitose, de dermatite atopique, de syndrome d’hyperéosinophilie…
La radiographie thoracique peut apporter des informations, les modifications sont cependant très variables et non corrélées à la sévérité des symptômes.
Une opacité bronchique à péribronchique est très souvent observée. Dans de rares cas, une atélectasie du lobe moyen est présente, celle ci fait suite à une obstruction complète de la lumière de la bronche souche. Des signes d’hyperinsufflation pulmonaire peuvent également être notés, il s’agit d’une augmentation de la taille du champ pulmonaire avec un aplatissement du diaphragme et une diminution de la densité pulmonaire.
Un pneumothorax et/ou un pneumomédiastin peuvent être mis en évidence.
Le développement d’un pneumothorax spontané est une complication fréquente et connue de l’asthme chez l’Homme, des cas de pneumomédiastin ont également été décrits.
Dans une étude portant sur les pneumothorax spontanés chez le chat, environ la moitié des cas est liée à l’évolution d’une inflammation bronchique. Il semble donc qu’il puisse en être de même chez le chat.
Ces épanchements aériques pourraient être la conséquence :
- D’une infection à Mycoplasma spp. : bactérie cytolytique, celle ci peut induire des lésions sévères de l’épithélium respiratoire.
- De l’effet trappe qui induit une distension puis une rupture alvéolaire.
Le pneumothorax correspond à la présence d’air dans l’espace pleural. Il peut être d’origine traumatique ou spontané.
Le pneumothorax traumatique fait suite à une lésion du parenchyme pulmonaire ou de la paroi thoracique.
Le pneumothorax spontané évolue quant à lui indépendamment de tout traumatisme. Il peut être :
- Primaire : il fait alors suite à la rupture d’une bulle ou de bleb apicaux, sans maladie pulmonaire sous jacente.
Alors que chez le chien, la majorité des pneumothorax spontanés est primaire, aucune description n’a encore été faite chez le chat.
- Ou secondaire : il est alors la conséquence d’une maladie pulmonaire.
Chez le chat, la majorité des pneumothorax se rencontre suite à un traumatisme. En dehors de ce contexte, une bronchite asthmatiforme est le plus souvent mise en cause, mais près d’un pneumothorax spontané sur deux ne trouve pas d’étiologie.
Le pneumomédiastin, correspond quant à lui à la présence d’air ou de gaz libre dans le médiastin. Il fait suite à une rupture de la trachée, des bronches ou alvéoles ou de l’œsophage. Lors d’atteintes des bronches ou des alvéoles, l’air dissèque le tissu périvasculaire et péribronchique et remonte par voie rétrograde jusqu’en région hilaire puis médiastinale.
Il a une origine :
- traumatique : perforation suite à une morsure, un corps étranger… ou iatrogène suite à une intubation, une insufflation…
- spontanée suite à l’évolution d’une maladie inflammatoire ou tumorale des voies aériennes par exemple. Chez l’Homme, les pneumomédiastins sont décrits lors d’asthme ou de bronchopneumopathies infectieuses à Mycoplasma) spp. (bactérie lytique à l’origine d’une lésion de l’épithélium respiratoire). Chez le chat, un cas de pneumomédiastin et d’emphysème sous cutané secondaire à une bronchopneumopathie nécrosante à Herpesvirus a été décrit.
Un pneumothorax ne peut pas être à l’origine d’un pneumomédiastin, en revanche, un pneumomédiastin peut entraîner un pneumothorax soit par rupture pleurale soit par étiologie commune (lésion bronchique ou alvéolaire).
L’intérêt du scanner dans l’évaluation des bronchites chroniques obstructives félines et des pneumothorax n’a pas encore démontré. De rares publications tendent cependant à démontrer l’intérêt de cet examen.
La réalisation d’un lavage bronchoalvéolaire est indispensable à la confirmation de l’hypothèse de bronchite chronique. Celui ci peut être réalisé en aveugle, la bronchoscopie n’apporte que peu d’information dans ce contexte et reste un examen risqué compte tenu du risque de bronchoconstriction. Un traitement à base de β-2 agoniste (terbutaline) est recommandé dans les 48 heures qui précèdent.
L’examen cytologique du liquide récolté montre une augmentation de la cellularité avec une majorité de granulocytes neutrophiles ou éosinophiles.
En cas d’inflammation éosinophilique, un diagnostic différentiel avec une parasitose ou un syndrome hyperéosinophilique doit être fait.
Un examen bactériologique doit systématiquement être réalisé sur le liquide récolté. Une attention particulière devra être portée à la recherche de Mycoplasma spp.
Chez l’Homme, le rôle de cette bactérie chez l’asthmatique est à l’origine d’un intérêt croissant. En modifiant le tonus des fibres musculaires lisses, elle pourrait aggraver ou induire une bronchite asthmatiforme. Chez le chat, cette association est également suspectée. La prévalence de cette bactérie peut atteindre 40% chez un chat asthmatique. Une recherche scrupuleuse de cet agent bactérien doit donc être conduite. Un milieu de culture spécifique est recommandé afin d’éviter les faux négatifs, le recours à la PCR est désormais recommandé.
Traitement
Le traitement d’un épisode aigu d’asthme repose en priorité sur l’administration d’oxygène et de bronchodilatateur. La cage à oxygène, moyen peu stressant d’augmenter la FiO2, est souvent préférée. Les bronchodilatateurs de choix sont les β-2 agonistes comme la terbutaline ou l’albutérol. Ils stimulent rapidement et sélectivement les récepteurs β provoquant ainsi une décontraction rapide des muscles lisses des voies respiratoires. Si après 20 à 30 minutes, aucun effet bénéfique n’est observé, l’administration de β-2 agoniste doit être renouvelée en association avec un corticoïde à action courte comme de la déxaméthasone.
La priorité est également de ne pas stresser l’animal. La réalisation de certains examens complémentaires devra être différée. Une tranquillisation est parfois intéressante. En cas de pneumothorax, le recours à la thoracocentèse devra être envisagée en cas de répercussion clinique importante. La cicatrisation de la brèche pleurale ou alvéolaire intervient rapidement. Elle passe par un repos strict et par la levée de l’effet trappe. Les récidives sont cependant possibles.
Le traitement sur le long terme de la bronchite chronique ou asthmatiforme repose principalement sur un traitement anti inflammatoire stéroïdien, la prednisolone. La posologie initiale recommandée est de 1 mg/kg PO BID avec une diminution progressive en cas de réponse favorable. Environ 25% des animaux nécessiteront un traitement à vie.
En cas de réponse non satisfaisante, l’association avec un bronchodilatateur, en particulier le salbutamol est conseillée.
Compte tenu des éventuels effets secondaires de la corticothérapie par voie générale, des traitements alternatifs ont été étudiés :
L’utilisation d’anti sérotoninergiques (cyproheptadine) ou de cyclosporine a été étudiée, mais leur bénéfice lors de bronchite chronique chez le chat n’a pu être déterminé. On ne peut donc pas recommander leur utilisation en lieu et place de la corticothérapie.
L’efficacité des corticoïdes par voie inhalée a en revanche été prouvée et leur utilisation est donc conseillée chez les animaux nécessitant un traitement au long cours. L’administration locale, c’est-à-dire directement au contact des voies aériennes, améliore l’efficacité thérapeutique alors que l’absence d’absorption systémique en minimise les effets secondaires habituels.
La commercialisation d’un système d’administration dédié au chat (Encadré 1) doit beaucoup à la « banalisation » de ce traitement et en facilite l’observance. La fluticasone est la molécule utilisée. L’administration doit être quotidienne, il faut en moyenne 10 à 14 jours pour que l’efficacité soit optimale. On recommande donc au cours de l’induction du traitement inhalé de poursuivre la corticothérapie par voie orale en diminuant progressivement la dose sur 2 à 3 semaines. Différents dosages (50, 125, 250 μg/dose) existent, bien qu’une étude ait prouvé que celui ci n’avait pas d’importance sur la réponse au traitement, on utilise couramment les dosages de 50 et 125 μg/dose.
L’utilisation d’antibiotiques est réservée au cas où l’examen cytobactériologique est positif. En cas de suspicion de mycoplasmose, le recours à la doxycycline est privilégié dans l’attente des résultats de l’analyse du lavage bronchoalvéolaire.
Des mesures hygiéniques doivent être instaurées. Elles passent par le retrait d’éventuels allergènes ou produits irritants de l’environnement de l’animal.
L’asthme félin ou bronchite chronique est la principale affection tussigène du chat. L’exploration d’un pneumothorax spontané chez le chat doit envisager cette maladie.

Tableau 2 : Médicament utilisé dans le traitement de l’asthme
Encadré 1 : Administration des médicaments inhalés chez le chat
Secouer l’inhalateur et le disposer dans la chambre d’inhalation reliée au masque.
- Appuyer à fond sur l’inhalateur afin de remplir la chambre d’inhalation.
- Placer le masque sur la tête du chat et le laisser respirer 10W15 fois environ.
- Si le chat est traité avec une association de fluticasone et de salbutamol, commencer par le bronchodilatateur.
On ne recommande pas de remplir la chambre avant de placer le masque sur la tête du chat car le remplissage de la chambre d’inhalation n’est alors pas optimal.

Photo 7 : Système d’administration dédié au chat, Aerokat ND.