Les cardiomyopathies dilatés du chien :
critères diagnostiques, pronostics et prise en charge thérapeutique

Image 1 Insuffisance mitrale fonctionnelle par dilatation de l’anneau mitral chez un chien atteint de cardiomyopathie dilatée (coupe grand axe quatre cavités par abord droit, mode Doppler couleur). Lors de cardiomyopathie dilatée, l’augmentation du volume télédiastolique dilate l’anneau mitral (flèches jaunes), écarte les piliers (flèche rouge) et exerce une traction excessive sur les cordages (flèche verte). Cette traction retient les feuillets valvulaires sous le plan de l’anneau mitral. Les feuillets ne coaptent plus et la valve fuit.
PHOTO :Dr É. BOMASSI
Les cardiomyopathies dilatées (CMD) sont des affections musculaires cardiaques, fonctionnelles ou lésionnelles. Elles se caractérisent par une altération de la contractilité ventriculaire qui occasionne un défaut d’éjection systolique et une dilatation des quatre cavités cardiaques, ou uniquement des cavités gauches. Elles peuvent être primitives (formes idiopathiques, dont la cause est inconnue, avec une probable part de prédisposition génétique) ou secondaires (forme dont l’origine est connue : infectieuse, toxique, métabolique, nutritionnelle, endocrinienne, tumorale, etc.).
Les formes primitives sont prédominantes (90 % des cas) et affectent préférentiellement les chiens de grandes races (dogues, mastiff, berger allemand). Une forme décrite classique est majoritaire. Des particularités raciales existent aussi : doberman, boxer, lévrier irlandais.
Le pronostic d’une cardiomyopathie est variable, et dépend de la présence ou non d’une insuffisance cardiaque (congestive ou non).

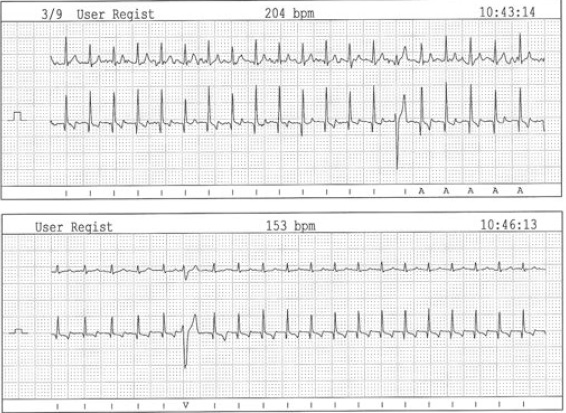
Image 2 – Extraits électrocardiographiques d’un examen Holter chez un doberman présentant une cardiomyopathie dilatée occulte forme arythmogène. Une arythmie ventriculaire gauche isolée et parfois interpolée (tracé du haut) est observée. Chez ce chien, le nombre d’accidents extrasystoliques sur 24 heures était supérieur à 10 000.
PHOTO : É. BOMASSI ET JF. ROUSSELOT
Critères diagnostiques
1-Forme classique
Le tableau clinique des CMD de forme classique est dominé par des signes congestifs : intolérance à l’effort, toux, dyspnée, épanchements. Un souffle cardiaque systolique apexien gauche d’origine fonctionnelle (dilatation de l’anneau mitral) est présent (photo 1). Les troubles du rythme supraventriculaire sont fréquents : fibrillation atriale, extrasystoles. Des troubles ventriculaires sont également présents (extrasystoles, tachycardie).
Les modifications morphologiques de l’électrocardiogramme sont celles qui sont classiques d’une cardiomégalie (grande onde R, augmentation de la durée du QRS, etc.).
Sur la radiographie, une cardiomégalie globale et marquée caractérise cette forme de cardiomyopathie, associée à des signes congestifs gauches et droits : œdème pulmonaire, dilatations veineuses pulmonaires, épanchements.
Les modifications échographiques sont caractérisées par une dilatation globale (ventriculaire et atriale), associée à un amincissement myocardique. La fonction systolique est altérée, avec un effondrement de la fraction de raccourcissement.
Une insuffisance mitrale faible à modérée est présente.
Des critères diagnostiques sont employés pour les formes classiques, qui utilisent une méthode de scorage (encadré 1) [8].
Encadré 2
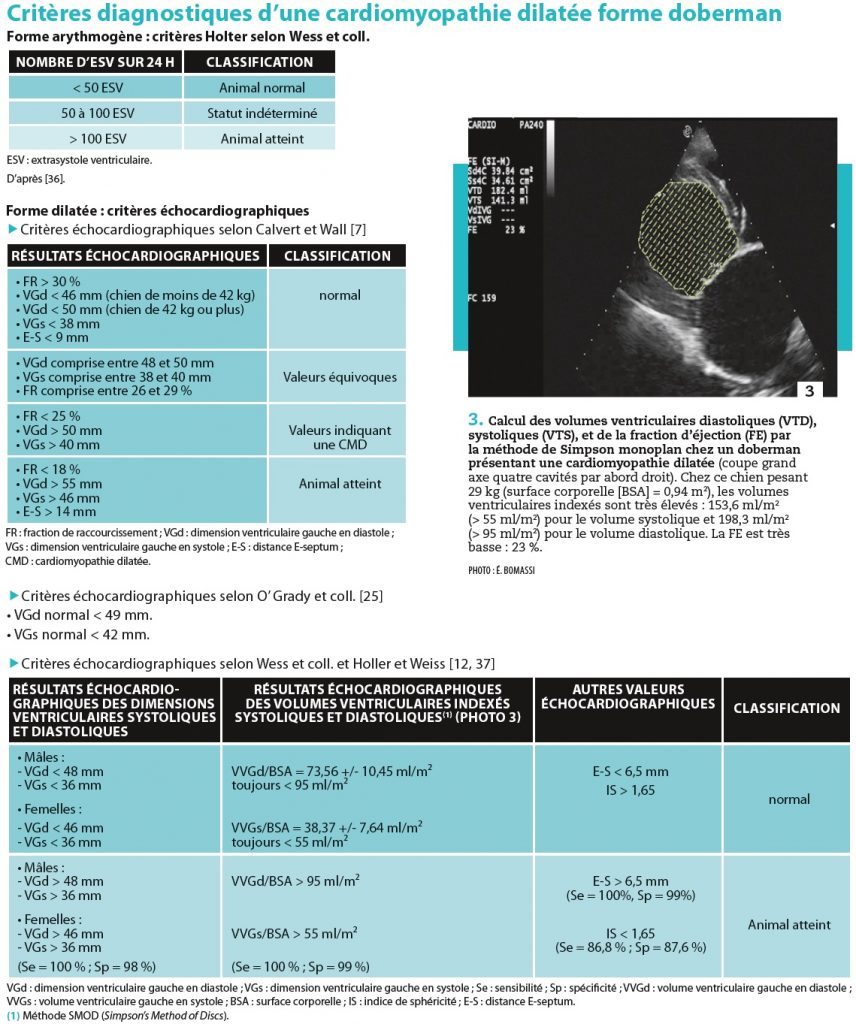
2-Forme doberman
Chez le doberman, l’affection est familiale. Elle est bien connue pour ses manifestations de syncopes et de mort subite par tachy- ou bradyarythmies, ou par une insuffisance cardiaque aiguë congestive gauche.
Deux formes de maladies existent (deux phénotypes) : CMD forme dilatée classique et CMD forme arythmogène, associées significativement à l’identification de deux mutations génétiques différentes, respectivement sur les chromosomes K 14 et K 5(1) [16, 17]. Néanmoins, une telle séparation, nette, n’est pas encore prouvée. Le mode de transmission est autosomal dominant à pénétrance incomplète et expression variable. Les mâles sont plus atteints que les femelles. La forme arythmogène est plus souvent rencontrée chez les femelles et la maladie est d’évolution lente. La forme dilatée classique est plus fréquente chez les mâles et d’évolution plus précoce vers une insuffisance cardiaque congestive que chez les femelles.
La prévalence d’une CMD de doberman est importante tous âges confondus (58,2 %) et augmente avec l’âge (3,3 % de 1 à 2 ans ; 9,9 % de 2 à 4 ans ; 12,6 % de 4 à 6 ans ; 43,6 % de 6 à 8 ans ; 44,1 % de chiens de plus de 8 ans) [36].
Les symptômes précurseurs sont souvent frustes, voire absents. La mort subite et les œdèmes pulmonaires aigus sont fréquents. Les épanchements sont rares. Comme dans la forme classique, la fibrillation atriale est fréquente.
Des troubles ventriculaires et de la conduction peuvent également être présents (photo 2). Des critères diagnostiques existent pour cette cardiomyopathie raciale particulière (encadré 2).
Plusieurs stades de la maladie sont déterminés (encadré 3).
Le dépistage de cette forme raciale nécessite ainsi une échocardiographie et un examen Holter, et est recommandé tous les ans à partir de l’âge de 2 ans, afin de repérer les formes dites occultes ou précliniques [36].
(1) Voir l’article “Génétique et cardiologie canine et féline : où en sommes nous ?” de A. Thomas, dans ce numéro.
3-Forme boxer
Chez le boxer, comme chez le doberman, la forme arythmogène (ARVD) est distinguée de la forme dilatée classique.
La forme ARVD, d’âge médian d’apparition à 6 ans, qui atteint autant les mâles que les femelles, est à support génétique et à transmission autosomale dominante, à pénétrance incomplète et à expression variable [18]. Des anomalies sur le chromosome K 17 sont observées [19]. Structurellement, les myocytes normaux sont remplacés par un tissu fibrograisseux. Des anomalies microscopiques de déstructuration des desmosomes (jonctions cellulaires) et de la bande Z (élargissement et déstructuration aussi) modifient le phénotype de la cellule, qui devient une cellule fibroblastique et graisseuse.
Ces changements intéressent en premier les cellules épicardiques et s’étendent progressivement vers l’endocarde. Ils peuvent toucher également le ventricule gauche et les deux atriums. Ce qui pourrait expliquer également l’apparition parfois de troubles ventriculaires gauches et l’évolution vers une CMD de forme classique. Cependant, de nombreux chiens ARVD ne connaissent jamais cette évolution [18].
Des lipothymies et des syncopes sont fréquentes. La mort subite est possible. L’auscultation d’un souffle cardiaque est très inconstante. Cette forme se caractérise par une faible dilatation des cavités cardiaques. Sur les clichés radiographiques, le coeur semble normal. Les signes congestifs sont également moins fréquents. Les modifications de l’électrocardiogramme (ECG) sont caractérisées par des arythmies ventriculaires (extrasystoles, tachycardie), responsables des morts subites observées.
Les critères diagnostiques de la forme arythmogène résultent de l’examen Holter (tableau 1) [18, 20, 21, 30].

Tableau 1 : Critères diagnostiques d’une cardiomyopathie
arythmogène du ventricule droit du boxer
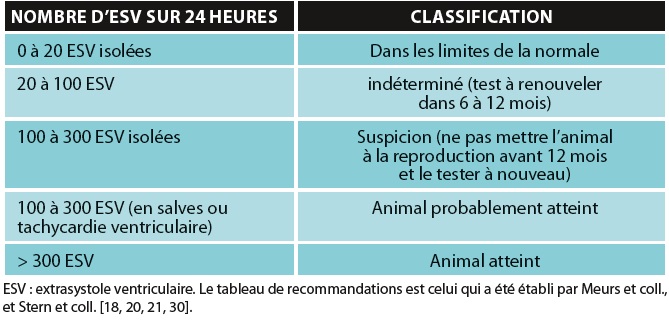
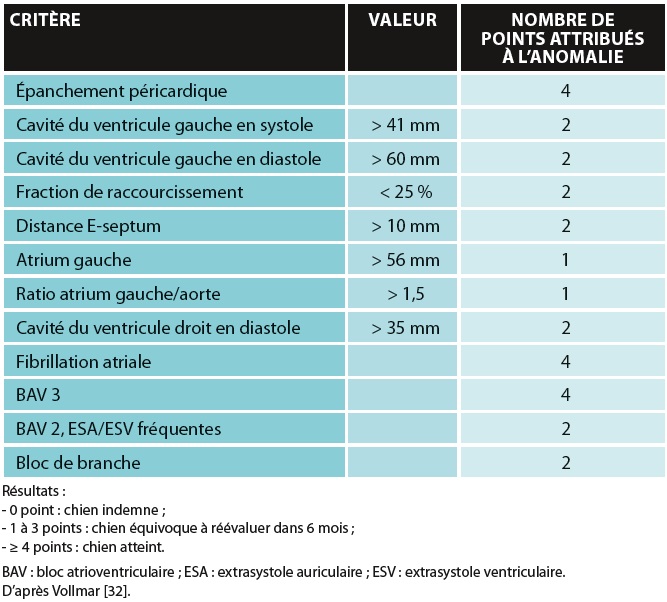
Tableau 2 : Critères diagnostiques d’une cardiomyopathie
dilatée de lévrier irlandais
4-Forme lévrier irlandais
Chez le lévrier irlandais, la maladie se présente cliniquement comme les formes classiques lors de décompensation : signes congestifs, fatigue et intolérance à l’effort. La prévalence dans la race est de 26,8 % [33, 34]. L’originalité y est une fibrillation atriale (FA) idiopathique (prévalence de 2,15 %), non consécutive à une dilatation atriale, mais pouvant, à terme, provoquer des altérations myocardiques mimant une cardiomyopathie dilatée [33, 34].
Histologiquement, les anomalies se caractérisent par des remaniements fibrograisseux non homogènes [34, 35] :
- sur le ventricule gauche, peu de remaniements sont observés (30 % des ventricules sont normaux, 70 % présentent des anomalies minimes à modérées) ;
- concernant le ventricule droit, 60 % sont normaux, sans remaniements fibrograisseux ;
- sur l’atrium droit, et lors de FA, la masse atriale est toujours augmentée, c’est-à-dire qu’une dilatation atriale droite est toujours présente, associée aux remaniements fibrograisseux et à une fibrose myocardique atriale. De plus, l’atrium droit est de plus grande taille que l’atrium gauche. Ces remaniements observés sur l’atrium droit sont probablement responsables de perturbations électriques possiblement responsables de la FA.
Cette maladie est significativement associée à l’identification de mutations sur les chromosomes K 1, K 10, K 15, K 17, K 21, et principalement sur le chromosome K 37 [27].
Ce chromosome K 37 contient le déterminant du métabolisme des lipides, donc il existe possiblement un lien avec les remaniements fibrograisseux observés, expliquant la physiopathologie de la maladie.
Le mode de transmission n’est pas clairement élucidé. Il pourrait être autosomale dominant ou lié au sexe (mutation liée à l’X).
Le diagnostic électrocardiographique (ECG classique ou enregistrement Holter) est primordial dans cette forme. En particulier, la FA est un critère majeur du diagnostic de CMD ou de celui de fibrillation idiopathique (tableau 2).
Hormis la présence d’une possible FA idiopathique, les anomalies échographiques lors de CMD sont identiques à celles de la forme classique.
5-Autres formes raciales
De nombreuses autres races semblent prédisposées aux CMD, pour lesquelles des descriptions sont disponibles.
De manière non exhaustive, il convient de citer le chien d’eau portugais (transmission autosomale récessive), le dogue allemand (infiltration fibrograisseuse des deux ventricules, mutation liée à l’X, transmission autosomale récessive), le terre-neuve (transmission autosomale dominante à pénétrance incomplète), le golden retriever (forme familiale carencée taurine), le chien de montagne portugais (infiltration fibrograisseuse et dysfonction sinusale), le bouledogue anglais (forme de maladie arythmogène de la chambre de chasse du ventricule droit) et le cocker américain (forme secondaire à une carence en taurine) [1, 2, 4, 11, 13-15, 28].

TRAITEMENT
Le traitement des cardiomyopathies est triple :
- la prise en charge en urgence lors d’insuffisance cardiaque aiguë congestive ;
- la prise en charge ambulatoire de la cardiopathie et de l’insuffisance cardiaque ;
- la prévention des formes asymptomatiques (formes raciales particulières).
1-Traitement d’urgence
Le traitement de l’urgence dépend de l’importance de la décompensation. Il est celui de l’insuffisance cardiaque congestive aiguë : diurèse forcée, vasodilatation, oxygénation, tranquillisation.
La particularité lors de cardiomyopathie est la gestion supplémentaire de la défaillance contractile, “pierre angulaire” responsable de l’insuffisance. Pour ce point, l’emploi d’inotropes ou d’inodilatateurs est indispensable.
2-Traitement ambulatoire
Le traitement ambulatoire de référence associe vasodilatateurs et inotropes, plusieurs études ayant montré un impact favorable de la combinaison des inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA) et du pimobendane chez des animaux en phase symptomatique [9, 23]. Des diurétiques sont indiqués dans la lutte contre les signes congestifs et l’augmentation de la précharge. Lors de trouble du rythme, un traitement spécifique est nécessaire (FA, extrasystoles ventriculaires ou supraventriculaires).
3-Prévention des formes asymptomatiques
La prévention des formes asymptomatiques concerne surtout les races doberman et boxer. La principale manifestation est représentée par des troubles rythmologiques responsables de mort subite. Le traitement de première intention utilise les antiarythmiques supraventriculaires (digoxine, diltiazem ou amiodarone) et le sotalol comme antiarythmique ventriculaire [10, 22]. En revanche, le choix d’une molécule et son administration doivent être réfléchis au préalable : identification du trouble rythmologique (ECG classique ou Holter), bilan hémodynamique cardiaque, évaluation de la fonction systolique. Chez le doberman, le pimobendane a prouvé son efficacité dans le traitement des formes asymptomatiques [31].
PRONOSTIC
Le pronostic des cardiomyopathies dilatées est toujours très réservé. Il dépend de la forme, mais également du stade d’évolution et des différentes présentations cliniques.
Ainsi, pour les formes classiques, et en l’absence de FA, la durée de vie médiane est de 24 mois chez des animaux qui répondent aux traitements. En présence de FA, elle chute à 6 mois [3]. Si des signes congestifs sont présents (épanchement pleural, ascite, œdème pulmonaire), la médiane de survie est de 114 jours [3]. Il en est de même (114 jours) lors de diminution importante de la fraction de raccourcissement (< 20 %) ou de flux transmitral restrictif [3]. Enfin, une valeur seuil de troponine I de 0,2 ng/ml indique une différence de pronostic vital entre 112 jours et 357 jours(B) [26].
1-Chez le doberman
Chez le doberman, et en l’absence de symptômes (forme occulte), des médianes de survie variables sont établies, en fonction des résultats des examens complémentaires de dépistage (Holter et dosage du NT-proBNP)(2) [29] :
- 469 jours pour un chien qui présente plus de 50 extrasystoles ventriculaires (ESV) par 24 heures ;
- 1 743 jours (espérance de vie normale) avec moins de 50 ESV par 24 heures ;
- 284 jours pour une valeur de NT-proBNP supérieure à 900 pmol/l ;
- 1 743 jours (espérance de vie normale) pour une valeur de NT-proBNP inférieure à 900 pmol/l ;
- 474 jours pour un animal atteint d’une CMD occulte ;
- 1 743 jours (espérance de vie normale) pour un individu indemne de CMD occulte.
L’utilisation du bénazépril (0,5 mg/kg/j en une prise) est recommandée pour retarder l’apparition de la décompensation, avec une durée médiane sans symptômes de 339 jours sans bénazépril et de 425 jours avec bénazépril [24].
De même, l’emploi du pimobendane (0,45 mg/kg/j en deux prises) en phase asymptomatique augmente le temps avant la décompensation (de 441 jours sans traitement à 718 jours avec traitement), ainsi que la durée de vie médiane (de 466 jours à 623 jours) [31].
Après décompensation, un traitement associant le pimobendane (0,3 à 0,6 mg/kg/j en deux prises) à de l’énalapril (0,5 à 1 mg/kg/j en une ou deux prises) et à du furosémide (2 à 9 mg/kg/j en plusieurs prises) offre une durée de vie médiane de 329 jours versus 50 jours seulement sans pimobendane [9].
Le temps moyen de traitement avant rechute est également augmenté en associant le pimobendane (0,5 mg/kg/j en deux prises) aux médicaments conventionnels (bénazépril, 1 mg/kg/j en deux prises, et furosémide, doses à effet), à 130,5 jours versus 14 jours [25].
Enfin, lors de forme symptomatique avec un trouble du rythme non traité, l’espérance de vie est de 11 jours seulement [6].
(2) Voir l’article “Les marqueurs cardiaques : le NT-proBNP et la troponine I” du même auteur, dans ce numéro.
2-Chez le boxer
Chez les boxers ARVD, la médiane de survie est de 11 ans, sans différence significative par rapport aux individus sains (médiane à 10 ans) [18]. Chez les animaux qui présentent des symptômes telles des syncopes, aucune preuve d’un lien entre la survenue de ces dernières et une mort subite n’a encore été apportée. Néanmoins, les chiens symptomatiques (syncopes) ont une espérance de vie plus courte (médiane de 365 jours) par rapport aux individus asymptomatiques (médiane de 693 jours), avec un risque 4,8 fois plus important de mort [5].
L’examen Holter, indispensable pour le diagnostic et le dépistage, est également un élément pronostique, associé aux résultats des autres examens complémentaires. Le risque de mort subite est augmenté en présence d’une tachycardie ventriculaire chez les mâles de plus de 4,5 ans, malgré des dimensions ventriculaires dans les valeurs usuelles (dimension ventriculaire gauche en diastole [VGd] < 35 mm) [23].
Conclusion
Les cardiomyopathies dilatées chez le chien sont des maladies d’origines, de présentations, d’évolutions et de pronostics très variables. La connaissance de l’ensemble des caractéristiques de ces affections, races-dépendantes, permet une prise en charge optimale.
Summary
Dilated cardiomyopathy in dogs: diagnostic criteria, prognosis and therapeutic management.
Dilated cardiomyopathy is a functional or lesional heart muscle disease. These conditions preferentially affect large size dogs and present as different forms: classic dilatation or particular racial types. Each form has specific determinants, and contributory and predisposing factors. The diagnosis of these diseases includes the clinical examination in addition to complementary examinations available in veterinary cardiology.
The prognosis is variable, depending on the breed, form and stage of development. The treatments are either general (management of heart failure) or more specific (particular racial forms).
Keywords
Dog, Dilated cardiomyopathy, Dobermann, Boxer, Irish Wolfhound.