Différents types d’opioïdes
Chaque opioïde peut se définir par son action sur les différents récepteurs.
Agonistes µ
Il s’agit de la morphine, du fentanyl, du tramadol et de la mépéridine 21, 25.
Morphine
La morphine est la molécule de référence. C’est un agoniste µ, κ et δ. Elle est disponible sous forme injectable (0,1, 1, 10, 20 ou 40 mg/mL) ou orale à libération prolongée (Skenan® 10, 20, 30, 60, 100 et 200 mg ou Kapanol® 20, 50, 100 mg) dans les pharmacies d’officine. Son obtention nécessite l’utilisation d’ordonnances sécurisées. Elle peut être administrée par voie intraveineuse (i.v.) lente, intramusculaire (i.m.), sous-cutanée (s.c.) ou orale (per os : p.o.).
Chez le chien, la dose, par voie injectable, est comprise entre 0,1 et 0,5 mg/kg 13, 25, 26. La dose de la forme orale est comprise entre 1,5 et 3 mg/kg toutes les 12 heures 17.
Chez le chat, seule la voie injectable est utilisée 17. La dose est comprise entre 0,05 et 0,2 mg/kg 2, 27.
Son délai d’action, lorsque la voie i.v. lente est utilisée, est d’environ cinq minutes. Il est d’environ 15 minutes pour la voie i.m., 30 minutes pour la voie s.c. et une heure pour la voie orale.
Sa demi-vie d’élimination est d’environ 90 minutes 28. Son effet analgésique dure en moyenne trois ou quatre heures pour les formes injectables et environ 12 heures pour les formes orales à libération prolongée 11, 17, 25.
Chez le chien et le chat, l’utilisation de morphine permet de diminuer la quantité d’isoflurane nécessaire pour abolir les réponses motrices aux stimulations nociceptives 12, 29. Cependant, chaque animal réagit différemment et l’effet analgésique des opioïdes doit être régulièrement évalué, afin de s’assurer du bon contrôle de la douleur. Il semblerait que l’administration de morphine en continu, par perfusion, soit très efficace pour contrôler la douleur 12, 30. Une étude portant sur 20 chiens subissant une laparotomie a comparé les effets de l’administration de morphine par perfusion, à la dose de 0,12 mg/kg par heure, versus par voie i.m., à la dose de 1,1 mg/kg toutes les quatre heures sur 24 heures. Aucune différence significative n’a été observée concernant l’état algique des animaux entre les deux groupes. Cependant, l’utilisation de morphine par perfusion permet de diviser de moitié la dose de morphine totale nécessaire sur 24 heures 30. La dose recommandée chez le chat et le chien est de 0,1 à 2 mg/kg par heure 11—13, 25, 29, 30.
Chez le chien, l’injection de morphine par voie i.v. pourrait provoquer un relargage histaminique pouvant mener à une hypotension. L’intensité de ce dernier dépendrait de la rapidité d’injection 25. Aussi, il est conseillé d’administrer la morphine par voie i.v. lente, sur environ une minute. L’utilisation de morphine sur des animaux anesthésiés peut provoquer un reflux gastro-oesophagien et donc être contre-indiquée pour certains types d’interventions chirurgicales. Il semble que cet effet soit dose-dépendant. Une étude portant sur 90 chiens a montré que 27 % des animaux n’ayant pas rec¸u de morphine, 50 % de ceux ayant rec¸u 0,22 mg/kg en i.m. et 60 % de ceux ayant reçu 1,1 mg/kg en i.m. ont présenté un reflux gastro-œsophagien 31.
Fentanyl
Le fentanyl est un opioïde de synthèse agoniste µ. Certains considèrent son pouvoir analgésique comme étant 80 à 150 fois plus puissant que celui de la morphine 25, 32. Il peut être administré par voie i.v. ou transdermique. Il est disponible en pratique vétérinaire sous sa forme injectable à 5 % depuis environ 18 mois. Son obtention se fait directement auprès des laboratoires AguettantTM, MerckTM, PanpharmaTM, Dakota PharmTM, RenaudinTM ou JanssenTM. Il est aussi disponible, en pharmacie d’officine, sous forme de patchs transdermiques (Durogesic®) qui diffèrent par leur débit d’administration : 25, 50, 75 et 100 µg par heure. L’obtention de fentanyl, quel que soit son conditionnement, nécessite l’utilisation d’ordonnances sécurisées.
C’est une molécule lipophile qui est rapidement redistribuée dans les tissus. Son action est plus rapide et plus brève que celle de la morphine. Après une injection de fentanyl par voie i.v., la concentration plasmatique de la molécule permettant d’obtenir une analgésie est atteinte en 2,5 minutes 32. Sa demi-vie d’élimination est de 45 minutes 32. Son effet clinique ne dure que 20 à 30 minutes 25. Cela impose donc une utilisation sous forme de perfusion, après l’administration d’un bolus de charge.
Chez le chien, la dose de charge est comprise entre 2 et 5µg/kg en bolus, suivie d’une perfusion comprise entre 2 et 10µg/kg par heure 9, 25, 32. Chez le chat, il est conseillé d’utiliser une dose de charge comprise entre 2 et 3 µg/kg en i.v. et une perfusion comprise entre 0,5 et 2,5 µg/kg par heure 9, 25, 33. Certains l’utilisent chez le chien en administrant des bolus successifs de 2,5 µg/kg toutes les 30 minutes 34.
Le fentanyl diminue significativement les quantités d’enflurane et d’isoflurane nécessaires pour abolir les réponses motrices aux stimulations nociceptives 35—37.
Chez le chien et le chat, pour différentes indications (laparoscopie, chirurgie orthopédique, onychectomie, stérilisation), le fentanyl est efficace pour traiter la douleur 34, 38—42.
Les dispositifs d’administration transdermique (patchs) sont disponibles pour quatre débits d’administration : 25, 50, 75 et 100 µg par heure 11, 25. Les doses recommandées sont les suivantes :
- un chat de plus de 2,3 kg et un chien de 3 à 10kg: patch de 25µg par heure ;
- un chien de 10 à 20 kg : patch de 50 µg par heure ;
- un chien de 20 à 30 kg : patch de 75 µg par heure ;
- un chien de plus de 30 kg : patch de 100 µg par heure 25, 43.
La concentration plasmatique effective de fentanyl est atteinte en 24 heures et reste stable pendant 48 heures (72 heures après la pose du dispositif) 25, 44. Plusieurs études ont prouvé l’efficacité de ce dispositif chez le chien et le chat dans le contrôle de la douleur provoquée par une chirurgie orthopédique, une onychectomie ou une ovariectomie 38—42, 45. Cependant, cette voie d’administration peut être décevante pour contrôler une douleur opératoire. La molécule active n’est dans le sang en concentration suffisante que 24 heures après la pose du dispositif 25, 44. Cela impose de voir l’animal la veille de l’intervention et interdit l’utilisation de ce dispositif sur toute intervention non prévue. La dose de molécule active effectivement absorbée est extrêmement variable d’un animal à l’autre 44, 45.
Il semble que le lieu d’application du patch (encolure, thorax, abdomen) induise des variations dans la quantité de produit absorbé 25, 46. L’hypothermie, souvent présente en période périopératoire, diminue significativement l’absorption transdermique de fentanyl 37, 47. La préparation de la peau est aussi à l’origine des variations d’absorption (utilisation de tondeuse, rasoir, crème dépilatoire, savon, alcool. . .). Ainsi, il est conseillé de préparer le lieu d’application par une tonte, les poils et d’éviter toute autre manipulation, comme l’épilation, le savonnage
ou l’application d’alcool 25, 48. L’utilisation d’un dispositif d’administration transdermique ne simplifie pas la tâche de l’équipe médicale.
Une étude a comparé deux groupes de chiens. L’un recevait de la morphine par voie i.m. toutes les quatre heures et l’autre, du fentanyl par voie transdermique. Les deux groupes ont nécessité la même surveillance postopératoire. Le taux de recours à un analgésique d’urgence était le même dans les deux groupes. Les dépenses financières engagées sur les animaux recevant du fentanyl étaient plus importantes 40. Selon les recommandations usuelles, ce dispositif oblige le praticien à traiter un animal de 11 kg avec la même dose qu’un animal de 19 kg. Il est impossible qu’ils reçoivent chacun une dose efficace de fentanyl avec le même patch. Soit l’un est surdosé, soit l’autre est sousdosé.
Il est formellement déconseillé de couper le patch car cela détruit la membrane alvéolée qui règle le débit d’administration et le produit peut se rependre sur la peau par le bord de coupe.
L’animal court alors un risque de surdosage. Il peut éventuellement être conseillé de recouvrir la moitié de la surface de contact avec la peau de manière à diminuer le débit. Ce dispositif interdit toute adaptation de la posologie sur des chiens qui ressentent des douleurs aiguës peropératoires. Enfin, aux États-Unis, la Food and Drug Administration a retiré son autorisation de mise sur le marché au patch de fentanyl pour le traitement des douleurs aiguës postopératoires chez les patients humains 40.
Tramadol
Le tramadol est un opioïde de synthèse qui possède un faible effet agoniste µ. Il est disponible sous forme injectable (Contramal®, Topalgic®, 100 mg/2 mL) ou orale (tramadol générique 50 mg) dans les pharmacies d’officine. Son obtention ne nécessite pas l’utilisation d’ordonnances sécurisées. En plus de son effet agoniste µ, il empêche aussi la recapture neuronale de noradrénaline et de sérotonine 15, 26, 49, 50.
Il est supposé que cet effet antisérotoninergique joue un rôle dans son pouvoir analgésique. Le tramadol est actif sous deux formes : le tramadol lui-même et la molécule M1 issue de sa métabolisation. La molécule M1 possède une affinité 200 fois supérieure pour les récepteurs µ que le tramadol. Son délai d’action chez les animaux de compagnie et sa demi-vie d’élimination n’ont pas été étudiés. Cependant, l’effet clinique est généralement observé dans les deux heures qui suivent son administration et dure environ six heures.
Chez le chien et le chat, la dose est de 1 à 4 mg/kg, i.v., p.o. 49—51. Sur des chiens subissant une intervention chirurgicale provoquant une douleur modérée (ovario-hystérectomie), il n’a pas été observé de différence significative entre un groupe ayant rec¸u du tramadol et un groupe ayant rec¸u de la morphine 49.
Chez le chien et le chat, le tramadol semble efficace pour la prise en charge des douleurs modérées, mais n’est pas indiqué dans le traitement des douleurs sévères 15, 26, 49, 50. Son efficacité est discutée chez le chat 51,52. Son utilisation pourrait être intéressante dans le traitement de l’allodynie et de l’hyperalgie provoquée par la sensibilisation centrale ou périphérique 15.
Les effets secondaires observés chez l’humain sont un état nauséeux, une constipation, des maux de tête, une somnolence, des vomissements, du prurit, une stimulation du système nerveux central, une asthénie, une sécheresse buccale et de la diarrhée 50.
Le tramadol est métabolisé par le foie. Il subit notamment une glucuronoconjugaison. Il est contre-indiqué en cas de troubles hépatiques 50.
Son effet sur la concentration de sérotonine contre-indique cette molécule lorsque les animaux rec¸oivent des traitements antidépresseurs, comme la séléginine, ou présentent des antécédents de crises convulsives 50.
Mépéridine ou péthidine
La péthidine est un opioïde de synthèse qui possède un faible effet agoniste µ, κ et δ. Elle a aussi pour effet de bloquer les canaux à sodium et l’activité de la corne dorsale comme un anesthésique local (lidocaïne, bupivacaïne. . .). Enfin, il semble qu’elle exerce un effet α2 agoniste comme la dexmédétomidine, la médétomidine, la romifine ou la xylazine 11. La péthidine est produite sous sa forme injectable (100 mg/2 mL) par le laboratoire RenaudinTM. Son obtention nécessite l’utilisation d’ordonnances sécurisées.
Sa dose chez le chien et le chat est comprise entre 4 et 8,8 mg/kg 11, 25, 26, 53—55. La péthidine ne s’administre que par voie i.m. ou s.c. car son utilisation i.v., même lente, peut déclencher un choc anaphylactique 25, 26, 55. Sa durée d’action est comprise entre 30 minutes et deux heures 11, 25, 54. À l’inverse des autres opioïdes, la péthidine possède un effet inotrope négatif qui contre-indique son utilisation sur les patients dont le statut cardiovasculaire est compromis. Elle exerce un effet atropine-like qui provoque une augmentation de la fréquence cardiaque 11.
La péthidine est moins efficace que la morphine pour prendre en charge les douleurs modérées. Elle n’est pas indiquée dans le traitement des douleurs sévères 53—55.
Agonistes—antagonistes
Les agonistes—antagonistes, comme le butorphanol (Dolorex®), sont des opioïdes de synthèse qui possèdent une action différente sur plusieurs récepteurs. Ils sont caractérisés par un effet µ antagoniste et un effet κ agoniste. L’effet analgésique du butorphanol découle de son interaction avec les récepteurs κ 9, 21, 25. Son effet µ antagoniste fait qu’il provoque moins d’effets secondaires indésirables (bradycardie, bradypnée, sédation) que les agonistes µ 9, 21, 25, 29, 56. Le butorphanol possède un effet plafond, c’est-à-dire que jusqu’à une concentration sanguine maximale, pour une dose administrée d’environ 0,4 mg/kg, les effets cliniques sont dose-dépendants. Lorsque cette concentration est atteinte, toute nouvelle administration ne produira plus d’effet cliniquement visible 25, 29.
Sa dose chez le chien et le chat est de 0,2 à 0,4 mg/kg. Il est administré par voie i.v., i.m. ou s.c. 29, 56. Son effet clinique apparaît en environ 30 minutes et sa durée d’action est comprise entre une et quatre heures 11,25. L’efficacité du butorphanol dans le traitement de la douleur a longtemps fait débat. En 1994, une étude menée sur six chiens n’a pas montré d’effet du butorphanol (0,2 mg/kg, 0,4 mg/kg ou 0,8 mg/kg en i.v.) sur la quantité d’halothane nécessaire pour abolir les réponses motrices aux stimulations nociceptives 57. À l’inverse, d’autres études menées chez le chien et le chat ont montré que le butorphanol (0,4 mg/kg ou 0,8 mg/kg en i.v.) diminuait significativement les quantités d’isoflurane nécessaires pour abolir les réponses motrices aux stimulations nociceptives 29, 56.
Plusieurs auteurs ont démontré que, chez le chien et le chat, pour différentes indications (laparotomie, cystotomie ou splénectomie, arthrotomie, synovite aiguë, ovario-hystérectomie, onychectomie, stérilisation), les anti-inflammatoires non stéroïdiens (kétoprofène, méloxicam, flunixine meglubine) utilisés seuls ou en association avec le butorphanol étaient plus efficaces pour traiter la douleur que le butorphanol utilisé seul 58—62.
Chez le chien, l’utilisation de butorphanol à la dose de 0,8 mg/kg s’est avérée efficace pour traiter la douleur d’origine viscérale 63.
Chez le chat, son utilisation à une dose comprise entre 0,1 et 0,4 mg/kg s’est avérée efficace pour traiter la douleur provoquée par une stimulation thermique 33, une onychectomie 64 ou une ovario-hystérectomie 65. Cependant, cet effet est de courte durée : une ou deux heures 33, 65. À ce jour, le butorphanol semble pouvoir être considéré comme satisfaisant pour traiter les douleurs modérées 29, 33, 56, 63—65. Son efficacité est accrue lorsqu’il est associé à des anti-inflammatoires non stéroïdiens ou à de la médétomidine 58—62, 65. Utilisé seul, le butorphanol n’est pas efficace pour prendre en charge des douleurs sévères 11, 25.
L’effet µ antagoniste du butorphanol peut être utilisé pour contrer les effets indésirables (bradycardie, bradypnée, sédation) provoqués par les agonistes purs (morphine, fentanyl). Son utilisation dans cette indication est très intéressante car, contrairement à celle d’un antagoniste pur comme la naloxone, elle permet de continuer à traiter la douleur par l’effet κ 9,25, 26.
Il a longtemps été considéré que l’utilisation conjointe d’agonistes purs et d’agonistes—antagonistes résultait dans une simple sommation de leurs effets. Cependant, deux études récentes ont bouleversé ces considérations.
Une étude menée par stimulation thermique sur six chats a montré que l’association de l’hydromorphone (agoniste pur) et du butorphanol avait un pouvoir analgésique inférieur à celui de l’hydromorphone utilisée seule. Cependant, l’analgésie était significativement plus longue (540 minutes versus 340 minutes) lorsque les deux molécules étaient associées 66.
À l’inverse, il a été montré, par inflation d’un ballonnet colique sur huit chats, que l’association de l’oxymorphone (agoniste pur) et du butorphanol était plus efficace dans le traitement de la douleur viscérale que l’une ou l’autre des molécules utilisées seules. Il a, de plus, été montré que les effets étaient synergiques et non simplement additifs 67.
Il semble que les interactions entre ces deux classes d’opioïdes soient bien plus complexes qu’il n’y paraît et de nouvelles recherches devront les étudier.
Agonistes partiels
La buprénorphine est un opioïde de synthèse qui possède une action agoniste partielle sur le récepteur µ et l’antagoniste sur les récepteurs κ 21, 25. Elle possède une affinité extrêmement forte pour ces récepteurs, mais n’entraîne pas une réponse clinique complète. Cela permet de limiter les effets secondaires indésirables (bradycardie, bradypnée, sédation). Elle possède aussi un effet plafond. Sa forme injectable, Temgesic® 0,3 mg/mL, est disponible auprès du laboratoire Schering-PloughTM et nécessite l’utilisation d’ordonnances sécurisées. La dose chez le chien et le chat est de 5 à 20µg/kg. L’administration en i.v. peut provoquer un relargage d’histamine. Elle ne s’administre donc que par voie i.m. Les effets cliniques sont observés une ou deux heures après l’injection et sa durée d’action est comprise entre six et 12 heures 11, 25, 26, 33. La pharmacocinétique de la molécule active est très variable d’un individu à l’autre. Cela explique que la durée d’action puisse passer du simple au double. Les éventuelles réadministrations de buprénorphine doivent être réalisées en fonction de la réponse clinique de chaque individu 68.
Différentes études chez le chien ont montré que la buprénorphine était efficace pour traiter la douleur provoquée par une arthrotomie ou une ovario-hystérectomie pendant les 24 heures qui suivent la chirurgie 69, 70.
Chez le chat, une dose de 10µg/kg est efficace pour traiter la douleur provoquée par une stimulation thermique, une onychectomie ou une ovario-hystérectomie 33, 71, 72.
Une étude portant sur 32 chats semble démontrer que, dans cette espèce, la buprénorphine, utilisée à 10 µg/kg en i.m., est plus efficace que la morphine, utilisée à 0,1 mg/kg, en i.m., pour traiter la douleur postopératoire pendant 420 minutes, qu’elle soit modérée ou sévère 73. Ces observations peuvent être dues au fait que la durée d’action de la morphine est plus courte que celle de la buprénorphine. Sur les 420 minutes d’évaluation, une partie des observations a été réalisée sur des animaux pour lesquels les effets de la morphine s’étaient dissipés.
Comme le butorphanol, la buprénorphine est considérée comme satisfaisante pour traiter les douleurs modérées. En l’état actuel des connaissances, il ne peut être conseillé de l’utiliser seule pour prendre en charge des douleurs sévères 11, 25, 33, 69, 70.
Elle peut avoir un rôle d’antagoniste sur les effets secondaires des agonistes µ 25, 26.
Sa forte affinité pour les récepteurs µ peut, dans certaines situations, poser problème. Elle est très difficile à antagoniser pendant les six à 12 heures de son action, même avec des antagonistes purs comme la naloxone.
De plus, lorsqu’elle est utilisée comme préanesthésique, elle limite le recours aux autres opioïdes, notamment les agonistes µ, car elle antagonise leurs effets par une affinité plus importante et une durée d’action plus longue 26.
Antagonistes
La naloxone est un opioïde de synthèse qui possède une forte affinité pour les récepteurs µ et κ, mais ne produit pas d’effet aux doses recommandées. Sa forte affinité pour ces derniers a pour conséquence qu’elle peut prendre la place de presque tous les autres opioïdes (naturels, synthétiques et endogènes), à l’exception de la buprénorphine, sans provoquer de réponse clinique. Il est important de noter que l’administration de naloxone antagonise tous les effets des opioïdes, y compris les effets analgésiques. Son utilisation doit être réservée aux urgences extrêmes. Son obtention (Naloxone®, Nalone®, Narcan® 0,4 mg/mL) se fait directement auprès d’une pharmacie d’officine et nécessite l’utilisation d’ordonnances sécurisées. Elle s’administre par voie i.v. La dose est de 1 à 25µg/kg. Il peut être intéressant de travailler avec les dosages les plus faibles et d’administrer plusieurs bolus successifs jusqu’à ce que l’effet souhaité soit obtenu. De cette manière, il peut être possible d’antagoniser les effets secondaires indésirables sans abolir la totalité de l’analgésie. Sa durée d’action est courte, entre 30 et 60 minutes. Son utilisation devra toujours se faire sous étroite surveillance afin qu’une renarcotisation puisse être évitée lorsque ses effets se dissipent 25.
En cas de renarcotisation, des bolus réitérés devront être administrés.
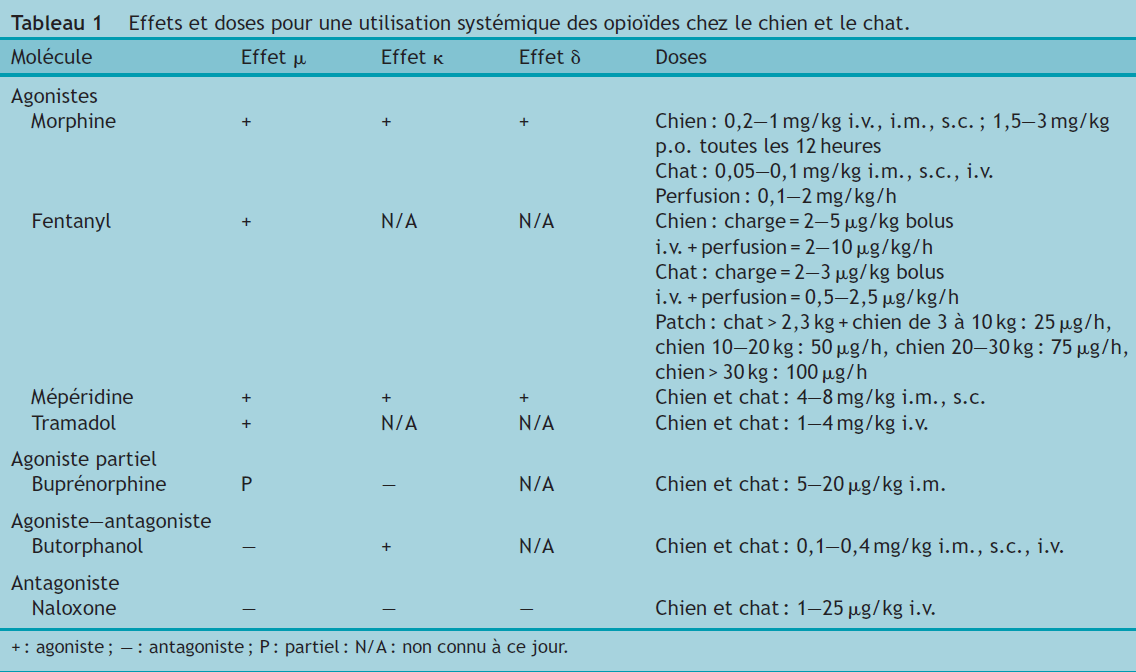
Le Tableau 1 présente une synthèse du mode d’action et des doses recommandées pour chacune des molécules présentées.
Conclusion
La compréhension des mécanismes physiologiques de la douleur, même si elle n’est pas complète, a permis de mettre en évidence certains processus clés. Ainsi, des étapes comme la facilitation cumulative (wind up), les sensibilisations centrale et périphérique ou l’hyperalgie peuvent être identifiées et spécifiquement traitées lors de l’établissement d’un plan d’analgésie.
La morphine et ses dérivés sont à ce jour les principes actifs analgésiques systémiques les plus efficaces, probablement parce qu’ils interviennent sur toutes les étapes de la propagation du message nerveux nociceptif. Il existe cependant de nombreuses situations cliniques dans lesquelles l’utilisation systémique des opioïdes seuls est insuffisante.
Le moment de l’administration d’un antalgique est crucial. Il est plus efficace s’il est administré avant la stimulation douloureuse. C’est le concept de l’analgésie préventive.
D’autres molécules, administrées par voie systémique, peuvent être associées aux opioïdes comme les α2 agonistes, les anti-inflammatoires (stéroïdiens ou non), les antagonistes NMDA (kétamine) ou certains anesthésiques locaux (lidocaïne). C’est le concept d’analgésie multimodale.
Enfin, il est possible d’utiliser les analgésiques par voie locale. L’anesthésie locorégionale est l’une des méthodes les plus efficaces. Un bloc peut être réalisé par l’administration d’un anesthésique local (lidocaïne ou bupivacaïne) directement dans l’entourage des nerfs dont dépend le site chirurgical. L’administration péridurale des antalgiques directement au contact du système nerveux central a aussi fait la preuve de son efficacité.